分步反应中,能量差最大的即为活化能(最大能垒)。
化学图中的能垒表示达到那个化学状态所需要的能量。
在受动力学限制的化学反应中,活化能 Ea 为活化碰撞的平均摩尔能量与所有碰撞的平均摩尔能量之差;而能垒E为活化络合。
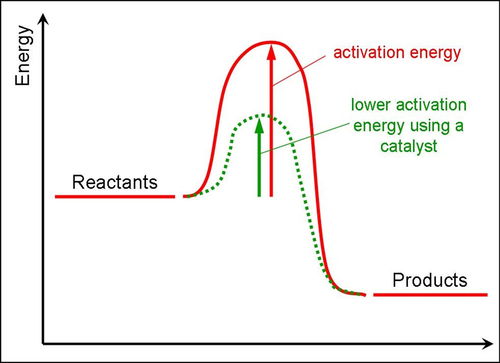
1、活化能,在化学中、生物化学中,活化能是指要使得一个化学反应 能完全进行的最小能量,也就是将所有的化学键刚好完全打破所需 要的最低能量。
.2、具体解说,请参看下面的图片解说;反应的图形,请参看下面各图片。
图。
1、活化能是一个化学名词,又被称为阈能。
2、这一名词是由阿伦尼乌斯(Arrhenius)在1889年引入,用来定义一个化学反应的发生所需要克服的能量障碍。
3、活化能可以用于表示一个化学反应发生所需要的最小能量。
反应的活化能通。
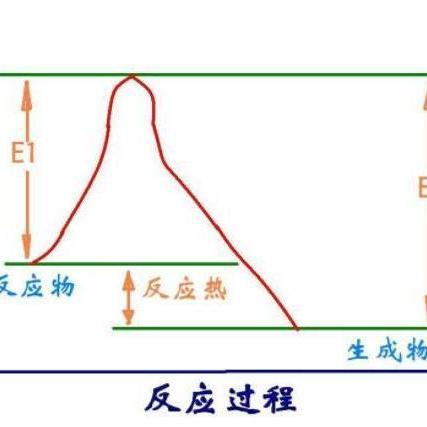
活化能 [huó huà néng]活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量。
(阿伦尼乌斯公式中的活化能区别于由动力学推导出来的活化能,又称阿伦尼乌斯活化能或经验活化能)。